วิเคราะห์ข้อสอบ
ปฏิกิริยาเคมี (chemical reaction) หมายถึง การเปลี่ยนแปลงที่ทำให้เกิดสารใหม่ มีสมบัติต่างจากสารเดิม สารก่อนการเปลี่ยนแปลงเรียกว่า สารตั้งต้น (reactant) และสารที่เกิดใหม่เรียกว่า ผลิตภัณฑ์ (product)
ในขณะที่เกิดปฏิกิริยาเคมี นอกจากได้สารใหม่แล้วยังอาจเกิดการเปลี่ยนแปลงในด้านอื่นๆ อีกได้ เช่น การเปลี่ยนแปลงพลังงาน
ตัวอย่างการเกิดปฏิกิริยาเคมีที่น่าสนใจเช่น
เมื่อนำลวดแมกนีเซียมใส่ลงในสารละลายกรดไฮโดรคลอริก เป็นปฏิกิริยาระหว่างโลหะ (แมกนีเซียม) กับกรด (กรดไฮโดรคลอริก) สารทั้งสองจะทำปฏิกิริยากัน เกิดการเปลี่ยนแปลงได้สารใหม่เกิดขึ้นดังสมการ
ในขณะที่เกิดปฏิกิริยาเคมี นอกจากได้สารใหม่แล้วยังอาจเกิดการเปลี่ยนแปลงในด้านอื่นๆ อีกได้ เช่น การเปลี่ยนแปลงพลังงาน
ตัวอย่างการเกิดปฏิกิริยาเคมีที่น่าสนใจเช่น
เมื่อนำลวดแมกนีเซียมใส่ลงในสารละลายกรดไฮโดรคลอริก เป็นปฏิกิริยาระหว่างโลหะ (แมกนีเซียม) กับกรด (กรดไฮโดรคลอริก) สารทั้งสองจะทำปฏิกิริยากัน เกิดการเปลี่ยนแปลงได้สารใหม่เกิดขึ้นดังสมการ
สารต่าง ๆ ที่อยู่รอบตัวเราเกือบทุกชนิด รวมทั้งที่นักเรียนมีอยู่ล้วนเกิดจากปฏิกิริยาเคมีทั้งสิ้น
1. ปฏิกิริยาเคมี
ใน ระหว่างการเกิดปฏิกิริยาเคมี อะตอมของสารตั้งต้นจะเกิดการแลกเปลี่ยนกันเกิดเป็นสารใหม่ที่แตกต่างกันไป จากสารตั้งต้น สารใหม่ที่ได้นี้ เรียกว่า ผลิตภัณฑ์
การ เกิดปฏิกิริยาเคมี เป็นการเปลี่ยนแปลงของสารที่ได้ผลิตภัณฑ์ของสารที่แตกต่างจากสารเดิมโดยอาจ สังเกตจากการเปลี่ยนสีของสาร การเกิดตะกอน หรือการเกิดกลิ่นใหม่
การเกิดปฏิกิริยาเคมีจะเกี่ยวข้องกับพลังงาน ดังนี้
1. เกิดการดูดพลังงานเข้าไปใช้ในการเปลี่ยนแปลง ทำให้สิ่งแวดล้อมเย็นลง อุณหภูมิลดลงเมื่อเอามือสัมผัสภาชนะจะรู้สึกเย็น
2. เกิด การคายพลังงานออกมาสู่สิ่งแวดล้อม ทำให้อุณหภูมิสูงขึ้น เมื่อเอามือสัมผัสภาชนะจะรู้สึกร้อน ถ้ามีการคายพลังงานอย่างมาก จะมีแสง เสียงระเบิด และประกายไฟเกิดขึ้น
2. ผลของปฏิกิริยาเคมี
ปฏิกิริยาที่พบเห็นในชีวิตประจำวันส่วนใหญ่เกิดจากปฏิกิริยาระหว่างสารกับออกซิเจน เช่น การเกิดสนิม ไฟไหม้ การกัดกร่อน เป็นต้น
หลัง จากการเกิดปฏิกิริยาเคมีอะตอมทั้งหมดของสารตั้งต้นไม่มีการสูญหายไปไหนแต่ เกิดการแลกเปลี่ยนจากสารหนึ่งไปสู่อีกสารหนึ่ง ซึ่งจะเห็นได้จากผลรวมของอะตอม ของสารตั้งต้นจะเท่ากับผลรวมของอะตอมของผลิตภัณฑ์ เราเรียกว่า สมดุลเคมี ตัวอย่าง เช่น เมื่อจุดเทียนบนขนมเค้กวันเกิด ขี้ผึ้งจากเทียนจะทำปฏิกิริยากับออกซิเจนในอากาศเรียกการเกิดปฏิกิริยานี้ ว่า ออกซิเดชั่น (oxidation)
3 การเขียนสมการเคมี
สมการ เคมี เป็นประโยชน์สัญลักษณ์ที่แสดงการเปลี่ยนแปลงของสาร ประกอบด้วยสารตั้งต้นและสารที่เป็นผลที่ได้ของปฏิกิริยา ซึ่งเรียกว่า ผลิตภัณฑ์ โดยเขียนในรูปสูตรของสารแต่ละชนิดในปฏิกิริยา เช่น
เหล็ก + กำมะถัน ----------------> เหล็กซัลไฟด์
Fe + S ------------------> FeS
โพแทสเซียมเปอร์แมงกาเนต โพแทสเซียมแมงกาเนต +
แมงกานีส (IV) ออกไซด์ + แก๊สออกซิเจน
2KMnO 4 ----------------> K 2 MnO 4 + MnO 2 + O2
(สารสีม่วงเข้ม) (สารสีเขียว) (สารสีดำ) (แก๊สไม่มีสี)
สมการที่ถูกต้อง จะต้องทำให้จำนวนอะตอมของธาตุเท่ากัน เช่น
แก๊สไฮโดรเจน + แก๊สออกซิเจน ----------------> น้ำ
H2 + O2 ----------------> H2 O
2H2 + O2 ----------------> 2H 2 O
(H มี 4 อะตอม) + (O มี 2 อะตอม ) ----------------> (H 4 อะตอม O 2 อะตอม)
4. ปฏิกิริยาระหว่างโลหะกับออกซิเจน
ออกซิเจน เป็นสารที่มีปฏิกิริยาว่องไวมาก โลหะส่วนใหญ่จะรวมกับออกซิเจนในอากาศเกิดเป็นออกไซด์ การเกิดปฏิกิริยาเช่นนี้เรียกว่า การกัดกร่อน ตัวอย่างเช่น การขึ้นสนิมที่เรียกว่า เหล็กออกไซด์ ซึ่งเป็นสารประกอบที่เราไม่ต้องการ สนิมจะเกิดขึ้นในที่ที่มีอากาศขึ้น โดยธาตุเหล็กจะถูกกัดกร่อน โดยรวมตัวกับธาตุออกซิเจน
แผนภาพข้างล่างแสดงสมดุลของปฏิกิริยาเคมี โดยมวลรวมก่อนเกิดปฏิกิริยาจะเท่ากับมวลรวมหลังปฏิกิริยา โดยที่อะตอมจะมาเรียงตัวกันใหม่
5. ปฏิกิริยาระหว่างโลหะกับน้ำ
โลหะ บางชนิดไม่เหมาะสำหรับใช้เป็นท่อส่งน้ำ เพราะโลหะนั้นจะเกิดปฏิกิริยากับน้ำ ทำให้เกิดสนิมปนเปื้อนในน้ำประปา ซึ่งอาจทำให้เกิดอันตรายต่อร่างกาย ปฏิกิริยาระหว่างโลหะกับน้ำ สามารถเขียนเป็นสมการได้ดังนี้
แต่ ไม่ใช่โลหะทุกชนิดที่จะเกิดปฏิกิริยากับน้ำ เช่น เราสามารถนำทองแดงมาทำเป็นท่อส่งน้ำได้ เพราะทองแดงเกิดปฏิกิริยากับน้ำได้ยากจึงไม่เกิดสนิม
6. ปฏิกิริยาระหว่างโลหะกับกรด
โลหะหลายชนิดสามารถทำปฏิกิริยากับกรด ได้เกลือของโลหะกับแก๊สไฮโดรเจน ดังสมการ
โลหะ + กรด ----------------> เกลือของโลหะ + ไฮโดรเจน
เช่น สังกะสี + กรดซัลฟิวริก ----------------> สังกะสีซัลเฟต + ไฮโดรเจน
โลหะ บางชนิด เช่น เงิน จะไม่ทำปฏิกิริยากับกรด ส่วนสังกะสี เหล็ก และ แมกนีเซียมทำปฏิกิริยาได้ดีกับกรด แต่ถ้าเป็นโลหะโซเดียมจะเกิดปฏิกิริยารวดเร็วและ รุนแรง
7. ปฏิกิริยาระหว่างกรดกับคาร์บอเนต
หิน ปูนเป็นหินซึ่งเกิดจากดินทรายที่ถูกพดพาลงไปทับถมกันในทะเลเป็นเวลานับล้าน ล้านปี ส่วนใหญ่เกิดจากเปลือกของสัตว์ทะเลขนาดเล็กที่ตายทับถามกันเป็นเวลานานมา แล้ว หินปูนประกอบด้วยสารประกอบที่เรียกว่า แคลเซียมคาร์บอเนต ที่สามารถสลายตัวได้ด้วยความร้อน ดังสมการ
แคลเซียมคาร์บอเนต ----------------> แคลเซียมออกไซด์ + คาร์บอนไดออกไซด์
CaCO3 (s) ----------------> CaC (s) + CO 2 ( g )
8. แคลเซียมคาร์บอเนต
เนื่องจากแคลเซียมไบคาร์บอเนตเมื่ออยู่ในน้ำร้อนจะเสถียรน้อยกว่าในน้ำเย็นมาก แคลเซียมคาร์บอเนต (ทราเวอไทน์) จึงตกตะกอนอยู่รอบ ๆ น้ำพุร้อน
น้ำ ในน้ำพุร้อนตอนเริ่มแรกอาจมาจากน้ำฝนบริสุทธิ์ แต่ต่อมาน้ำนี้ไหลหมุนเวียนผ่านทางใต้ดินและละลายหินที่ไหลผ่านจนเป้นสาร ละลายที่มีแคลเซียมคาร์บอเนตละลายอยู่มากพอควร เมื่อน้ำนี้ไหลขึ้นสู่พื้นดินจะเย็นลง ทำให้แคลเซียมคาร์บอเนตตกตะกอนเป็นแผ่นผลึกแคลไซต์สีขาวส่องแสงระยิบระยับ เมื่อกระทบแสงอาทิตย์
ตอบ ข้อ 2
วิเคราห์ข้อสอบ
ปฏิกิริยาเคมี (chemical reaction) หมายถึง การเปลี่ยนแปลงที่ทำให้เกิดสารใหม่ มีสมบัติต่างจากสารเดิม สารก่อนการเปลี่ยนแปลงเรียกว่า สารตั้งต้น (reactant) และสารที่เกิดใหม่เรียกว่า ผลิตภัณฑ์ (product)
ในขณะที่เกิดปฏิกิริยาเคมี นอกจากได้สารใหม่แล้วยังอาจเกิดการเปลี่ยนแปลงในด้านอื่นๆ อีกได้ เช่น การเปลี่ยนแปลงพลังงาน
ตัวอย่างการเกิดปฏิกิริยาเคมีที่น่าสนใจเช่น
เมื่อนำลวดแมกนีเซียมใส่ลงในสารละลายกรดไฮโดรคลอริก เป็นปฏิกิริยาระหว่างโลหะ (แมกนีเซียม) กับกรด (กรดไฮโดรคลอริก) สารทั้งสองจะทำปฏิกิริยากัน เกิดการเปลี่ยนแปลงได้สารใหม่เกิดขึ้นดังสมการ

ในขณะที่เกิดปฏิกิริยาเคมี นอกจากได้สารใหม่แล้วยังอาจเกิดการเปลี่ยนแปลงในด้านอื่นๆ อีกได้ เช่น การเปลี่ยนแปลงพลังงาน
ตัวอย่างการเกิดปฏิกิริยาเคมีที่น่าสนใจเช่น
เมื่อนำลวดแมกนีเซียมใส่ลงในสารละลายกรดไฮโดรคลอริก เป็นปฏิกิริยาระหว่างโลหะ (แมกนีเซียม) กับกรด (กรดไฮโดรคลอริก) สารทั้งสองจะทำปฏิกิริยากัน เกิดการเปลี่ยนแปลงได้สารใหม่เกิดขึ้นดังสมการ
เขียนเป็นสัญลักษณ์ของธาตุและสารประกอบในปฏิกิริยาได้ดังนี้
Mg = แมกนีเซียม
HCl = กรดไฮโดรคลอริก (กรดเกลือ)
MgCl2 = แมกนีเซียมคลอไรด์
H2 = ไฮโดรเจน
Mg = แมกนีเซียม
HCl = กรดไฮโดรคลอริก (กรดเกลือ)
MgCl2 = แมกนีเซียมคลอไรด์
H2 = ไฮโดรเจน
เขียนเป็นสัญลักษณ์ของธาตุและสารประกอบในปฏิกิริยาได้ดังนี้
K = โพแทสเซียม
HCl = กรดไฮโดรคลอริก (กรดเกลือ)
KCl = โพแทสเซียมคลอไรด์
H2 = ไฮโดรเจน
K = โพแทสเซียม
HCl = กรดไฮโดรคลอริก (กรดเกลือ)
KCl = โพแทสเซียมคลอไรด์
H2 = ไฮโดรเจน
เขียนเป็นสัญลักษณ์ของธาตุและสารประกอบในปฏิกิริยาได้ดังนี้
Na = โซเดียม
HCl = กรดไฮโดรคลอริก (กรดเกลือ)
NaCl = โซเดียมคลอไรด์ (เกลือแกง)
H2 = ไฮโดรเจน
Na = โซเดียม
HCl = กรดไฮโดรคลอริก (กรดเกลือ)
NaCl = โซเดียมคลอไรด์ (เกลือแกง)
H2 = ไฮโดรเจน
แต่ถ้าเปลี่ยนสารตั้งต้นของปฏิกิริยาจากกรดไฮโดรคลอริก (HCl) เป็นน้ำ (H2O) สามารถเขียนความสัมพันธ์ระหว่างสารตั้งต้น เป็นผลิตภัณฑ์ได้ดังนี้
เขียนเป็นสัญลักษณ์ของธาตุและสารประกอบในปฏิกิริยา ได้ดังนี้
Mg = แมกนีเซียม
H2O = น้ำ
Mg(OH)2 = แมกนีเซียมไฮดรอกไซด์
H2 = ไฮโดรเจน
Mg = แมกนีเซียม
H2O = น้ำ
Mg(OH)2 = แมกนีเซียมไฮดรอกไซด์
H2 = ไฮโดรเจน
เขียนเป็นสัญลักษณ์ของธาตุและสารประกอบในปฏิกิริยาได้ดังนี้
Na = โซเดียม
H2O = น้ำ
NaOH = โซเดียมไฮดรอกไซด์
H2 = ไฮโดรเจน
Na = โซเดียม
H2O = น้ำ
NaOH = โซเดียมไฮดรอกไซด์
H2 = ไฮโดรเจน
เขียนเป็นสัญลักษณ์ของธาตุและสารประกอบในปฏิกิริยาได้ดังนี้
Ca = แคลเซียม
H2O = น้ำ
Ca(OH)2 = แคลเซียมไฮดรอกไซด์
H2 = ไฮโดรเจน
ตอบ ข้อ 4
วิเคราะห์ข้อสอบ
กรดกำมะถัน หรือ กรดซัลฟิวริก (อังกฤษ: sulfuric acid หรือ อังกฤษบริติช: sulphuric acid) , H2SO 4, เป็น กรดแร่ (mineral acid) อย่างแรง ละลายได้ในน้ำที่ทุกความเข้มข้น ค้นพบโดย จาเบียร์ เฮย์ยัน (Jabir Ibn Hayyan) นักเคมีชาวอาหรับ พบว่ากรดซัลฟิวริกมีประโยชน์มากมายและเป็นสารเคมีที่มีการผลิตมากที่สุด รองจากน้ำ ในปี ค.ศ. 2001 ทั่วโลกผลิตรวมกันประมาณ 165 ล้านตัน ซึ่งมูลค่าประมาณ 320,000 ล้านบาท (8 พันล้านดอลลาร์สหรัฐ) ประโยชน์ของกรดกำมะถันได้แก่ ใช้ในการผลิตปุ๋ย กระบวนการผลิตแร่ การสังเคราะห์เคมี การกำจัดน้ำเสีย ใช้เป็นสารละลายอิเล็กทรอไลต์ในแบตเตอรี่และกระบวนการกลั่นน้ำมัน กรดกำมะถันมีชื่อเดิมคือ "Zayt al-Zaj" หรือ "ออยล์ออฟวิตริออล" (oil of vitriol)
กรดไนตริก (HNO3), หรือ ที่ชาวบ้านทั่วไปเรียกว่ากรดดินประสิว เป็นกรดที่มีอันตรายมาก หากสัมผัสจะทำให้เกิดแผลไหม้ขั้นรุนแรง กรดไนตริกนี้ ค้นพบโดยการสังเคราะห์ โดย Muslim alchemist Jabir ibn Hayyan.ประมาณ ค.ศ.800
กรดบริสุทธิ์ จะใส ไร้สี หากเก็บไว้นานจะมีสีเหลือง เนื่องจากมีส่วนประกอบของ ออกไซโของไนโตรเจน หากกรดมีความเข้มข้นสูงเกินกว่า 86% จะมีไอระเหยของกรดขึ้นมา ไอของกรดที่ระเหยออกมาจะเป็นมีขาว หรืออาจเป็นสีแดงขึ้นอยู่กับความเข้มข้นของไนโตรเจนไดออกไซด์ที่เกิดขึ้น
คุณสมบัติ
กรดไนตริกบริสุทธ์ 100% (ปราศจากน้ำ) จะเป็นของเหลวที่มีความหนาแน่น 1,552 กิโลกรัม/ลูกบาศก์เมตร และจะเป็นของแข็งที่อุณหภูมิ -42 °C ลูกบาศก์ โดยจะเป็นผลึกสีขาว และจะเดือดที่อุณหภูมิ 83 °C แต่ก็สามารถเดือดในที่ ที่มีแสงสว่าง ทั้ง ๆ ที่อยู่ในอุณหภูมิห้อง จะมีการสลายตัวในรูปแบบไนโตรเจนไดออกไซด์ ตามปฏิกิริยา ดังนี้
กรดไนตริกบริสุทธ์ 100% (ปราศจากน้ำ) จะเป็นของเหลวที่มีความหนาแน่น 1,552 กิโลกรัม/ลูกบาศก์เมตร และจะเป็นของแข็งที่อุณหภูมิ -42 °C ลูกบาศก์ โดยจะเป็นผลึกสีขาว และจะเดือดที่อุณหภูมิ 83 °C แต่ก็สามารถเดือดในที่ ที่มีแสงสว่าง ทั้ง ๆ ที่อยู่ในอุณหภูมิห้อง จะมีการสลายตัวในรูปแบบไนโตรเจนไดออกไซด์ ตามปฏิกิริยา ดังนี้
4HNO3 → 2H2O + 4NO2 + O2 (72°C)
ตอบ ข้อ 4
วิเคราะห์ข้อสอบ
เลขอะตอม (Atomic number : Z) เป็นค่าเฉพาะของธาตุแต่ละชนิดแสดงจำนวนโปรตอนในนิวเคลียส 1 อะตอม
ของธาตุนั้น ซึ่งอะตอมของธาตุชนิดเดียวกันต้องมีจำนวนโปรตอนเท่ากันเสมอ
ของธาตุนั้น ซึ่งอะตอมของธาตุชนิดเดียวกันต้องมีจำนวนโปรตอนเท่ากันเสมอ
เลขอะตอม (Z) = จำนวนโปรตอน (p) |
เลขมวล (Mass number, A) เป็นตัวเลขแสดงผลบวกของจำนวนโปรตอนกับนิวตรอนของธาตุ ถ้าทราบเลขอะตอม
จะสามารถหาจำนวนนิวตรอนของอะตอมได้โดยนำเลขอะตอมไปลบเลขมวล
จะสามารถหาจำนวนนิวตรอนของอะตอมได้โดยนำเลขอะตอมไปลบเลขมวล
เลขมวล(A) = จำนวนโปรตอน (p) + จำนวนนิวตรอน (n) |
ถ้าทราบเลขอะตอมสามารถหานิวตรอนได้ ดังนี้
จำนวนนิวตรอน (n) = เลขมวล (A) - จำนวนโปรตอน (p) |
หรือ = เลขมวล (A) - เลขอะตอม (Z) |
ตัวอย่างสัญลักษณ์นิวเคลียร์ของธาตุ
 | สัญลักษณ์นิวเคลียร์ธาตุออกซิเจน (O) เลขมวล=16 เลขอะตอม= 8 | |
 | สัญลักษณ์นิวเคลียร์ธาตุนีออน (Ne) เลขมวล=20 เลขอะตอม=10 |
2.3 การคำนวณอนุภาคมูลฐานของอะตอมจากสัญลักษณ์นิวเคลียร์
ลักษณะของสัญลักษณ์นิวเคลียร์
1) อะตอมของธาตุเป็นกลางทางไฟฟ้า คือ อะตอมของธาตุที่มีจำนวนโปรตอนเท่ากับจำนวน
อิเล็กตรอน เช่น
อิเล็กตรอน เช่น
 |
2) ไอออน (ion) คืออนุภาคที่มีประจุไฟฟ้าเกิดจากจำนวนโปรตอนกับจำนวนนิวตรอนภายในแตกต่างกัน
เนื่องจากจำนวนอิเล็กตรอนเปลี่ยนไป ไอออนแบ่งเป็น 2 ชนิด ดังนี้
เนื่องจากจำนวนอิเล็กตรอนเปลี่ยนไป ไอออนแบ่งเป็น 2 ชนิด ดังนี้
(1) ไอออนลบ (anion) หมายถึง อะตอมรับอิเล็กตรอนหรืออะตอม ที่มีอิเล็กตรอน มากกว่าโปรตอน เช่น
ฟลูออรีน 1- หมายถึง | มีอิเล็กตรอนมากกว่าโปรตอน 1 อนุภาคฟลูออรีนไอออน มีโปรตอน = 9 อนุภาค มีอิเล็กตรอน = 9 + 1 = 10 อนุภาค | |
ไนโตรเจน 3- หมายถึง | มีอิเล็กตรอนมากกว่าโปรตอน 3 อนุภาค ไนโตรเจนไอออนมีโปรตอน = 7 อนุภาค มีอิเล็กตรอน = 7 + 3 = 10 อนุภาค |
(2) ไอออนบวก (cation) หมายถึง อะตอมที่ให้อิเล็กตรอนไปหรืออะตอมมีอิเล็กตรอนน้อยกว่าโปรตอน เช่น
 | แคลเซียม 2+ หมายถึง | มีอิเล็กตรอนน้อยกว่าโปรตอน 2 อนุภาค แคลเซียมไอออน มีโปรตอน = 20 อนุภาค มีอิเล็กตรอน = 20 - 2 = 18 อนุภาค |
 | ลิเทียม 1+ หมายถึง | มีอิเล็กตรอนน้อยกว่าโปรตอน 1 อนุภาค ลิเทียมไอออนมีโปรตอน = 3 อนุภาค มีอิเล็กตรอน = 3 - 1 = 2 อนุภาค |
 |
ตัวอย่างที่ 1 การหาอนุภาคมูลฐานของอะตอมธาตุโซเดียมจากสัญลักษณ์นิวเคลียร์

ตัวอย่างที่ 2 การหาอนุภาคมูลฐานของอะตอมธาตุอะลูมิเนียมจากสัญลักษณ์นิวเคลียร์
 |
ตัวอย่างที่ 3 การหาอนุภาคมูลฐานของอะตอมโบรมีนจากสัญลักษณ์นิวเคลียร์
 |
2.4 คำศัพท์ที่ควรทราบ
 |
ตอบ ข้อ 1
ที่มา . wapedia.mobi/th/เลขอะตอม
วิเคราะห์ข้อสอบ
เลขมวล (mass number, A), หรือ เลขมวลอะตอม หรือ เลขนิวคลีออน เป็นผลรวมของจำนวนโปรตอนและนิวตรอน (โปรตอนและนิวตรอมเรียกรวมกันว่านิวคลีออน) ในนิวเคลียสอะตอม เพราะโปรตอนและนิวตรอนต่างก็เป็นแบริออน เลขมวล A ก็คือเลขแบริออน B ของนิวเคลียสของอะตอมหรือไอออน เลขมวลจะต่างกันถ้าเป็นไอโซโทปที่ต่างกันของธาตุเคมี เลขมวลไม่เหมือนกับเลขอะตอม (Z) ที่แสดงถึงจำนวนโปรตอนในนิวเคลียสและสามารถใช้ระบุบธาตุได้ ดังนั้นค่าที่ต่างกันระหว่างเลขมวลและเลขอะตอมจะบ่งบอกถึงจำนวนนิวตรอน (N) ในนิวเคลียส: N=A−Z[1]
เลขมวลจะถูกเขียนอยู่ด้ายหลังหรือมุมบนด้านซ้ายของสัญลักษณ์ธาตุ เช่น ไอโซปโทปปกติของคาร์บอนคือ คาร์บอน-12 หรือ 12C ซึ่งมี 6 โปรตรอนและ 6 นิวตรอน สัญลักษณ์ไอโซปแบบเต็มรูปแบบจะมีเลขอะตอม (Z) ด้วยอยู่ด้านล่างซ้ายมือของสัญลักษณ์ธาตุ: 6C[2] ซึ่งวิธีนี้ไม่มีความจำเป็นนักจึงนิยมละเลขอะตอมไว้
ตัวอย่าง: การสลายในธรรมชาติของคาร์บอน-14จะแผ่รังสีเบต้า ด้วยวิธีนิวตรอนหนึ่งตัวถูกทำให้เปลี่ยนสถานะกลายเป็นโปรตอนกับการปล่อยพลังงานของอิเล็กตรอนและอนุภาคต้าน ดังนั้นเลขอะตอมจะเพิ่มขึ้น 1 (Z: 6→7) และเลขมวลมีค่าเท่าเดิม (A = 14) ขณะที่เลขนิวตรอนลดลง 1 (n: 8→7)[3] อะตอมผลลัพธ์เป็นอะตอมไนโตรเจน-14ซึ่งมี 7 โปรตอนและ 7 นิวตรอน:
- 6C → 7N + e- + ve
ยูเรเนียม-238ปกติจะสลายให้รังสีแอลฟาซึ่งนิวเคลียสเสีย 2 นิวตรอนและ 2 โปรตรอนในรูปแบบของอนุภาคแอลฟา ดังนั้นเลขอะตอมและเลขนิวตรอนจะลดลงไป 2 (Z: 92→90, n: 146→144) ซึ่งเลขมวลจะลดไป 4 (A = 238→234) อะตอมผลลัพธ์เป็นอะตอมทอเรียม-234 และอนุภาคแอลฟา (2He2+):[4]
- 92U → 90Th + 2He2+
ตอบ ข้อ 2
วิเคราะห์ข้อสอบ

จากการเรียงอิเล็กตรอนของธาตุในระดับพลังงานหลักทำให้ทราบว่า
1. จำนวน ระดับพลังงานหลักของอิเล็กตรอน ทำให้ทราบว่าธาตุนั้นอยู่คาบใด ถ้าธาตุมีจำนวนระดับพลังงานของอิเล็กตรอนเท่ากัน แสดงว่าธาตุนั้นอยู่ในคาบเดียวกัน เช่นMg มีเลขอะตอม 12 มีการจัดอิเล็กตรอนในระดับพลังงานดังนี้ 2, 8, 2 Mg มี 3 ระดับพลังงานS มีเลขอะตอม 16 มีการจัดอิเล็กตรอนในระดับพลังงานดังนี้ 2, 8, 6 S มี 3 ระดับพลังงาน
แสดงว่า Mg และ S อยู่ในคาบเดียวกัน
แสดงว่า Mg และ S อยู่ในคาบเดียวกัน
2 จำนวน เวเลนซ์อิเล็กตรอน หรืออิเล็กตรอนที่อยู่ในระดับพลังงานนอกสุด ทำให้ทราบหมู่ของธาตุ ถ้าธาตุมีจำนวนเวเลนซ์อิเล็กตรอนเท่ากัน แสดงว่าธาตุนั้นอยู่ในหมู่เดียวกัน เช่น Na มีเลขอะตอม 11 มีการจัดอิเล็กตรอนในระดับพลังงานดังนี้ 2, 8, 1 Na มีเวเลนซ์อิเล็กตรอนเท่ากับ 1
K มีเลขอะตอม 19 มีการจัดอิเล็กตรอนในระดับพลังงานดังนี้ 2, 8,8, 1 K มี เวเลนซ์อิเล็กตรอนเท่ากับ แสดงว่า ธาตุ Na และ K อยู่ในหมู่เดียวกัน
K มีเลขอะตอม 19 มีการจัดอิเล็กตรอนในระดับพลังงานดังนี้ 2, 8,8, 1 K มี เวเลนซ์อิเล็กตรอนเท่ากับ แสดงว่า ธาตุ Na และ K อยู่ในหมู่เดียวกัน
การจัดเรียงอิเล็กตรอนในระดับพลังงานย่อย
การ จัดอิเล็กตรอนในระดับพลังงานหลัก ทำให้แต่ละระดับพลังงานมีจำนวนอิเล็กตรอนมากจึงเกิดปัญหาว่าอิเล็กตรอนเหล่า นั้นอยู่ในระดับพลังงานเดียวกันได้อย่างไร ทำไมจึงไม่ผลักกัน เพื่อแก้ปัญหาดังกล่าว นักวิทยาศาสตร์จึงได้ศึกษาเกี่ยวกับระดับพลังงานย่อยเพื่อกระจายอิเล็กตรอน ในแต่ละระดับพลังงานหลัก เข้าสู่ระดับพลังงานย่อย โดยอาศัยรูปแบบโคจรของอิเล็กตรอนรอบ ๆ นิวเคลียสเป็นเกณฑ์ในการแบ่งอิเล็กตรอนเป็นกลุ่มย่อย ๆ และเรียกรูปแบบวงโคจรนี้ว่าออร์บิทัล (Orbital) โดย 1 ออร์บิทัลจะมีอิเล็กตรอนได้ไม่เกิน 2 อิเล็กตรอน ระดับพลังงานย่อยมี 4 ระดับ คือ s, p, d, f โดยระดับพลังงานย่อยมี
s มี 1 ออร์บิทัล บรรจุอิเล็กตรอนได้สูงสุด 2 อิเล็กตรอน
p มี 3 ออร์บิทัล บรรจุอิเล็กตรอนได้สูงสุด 6 อิเล็กตรอน
d มี 5 ออร์บิทัล บรรจุอิเล็กตรอนได้สูงสุด 10 อิเล็กตรอน
f มี 7 ออร์บิทัล บรรจุอิเล็กตรอนได้สูงสุด 14 อิเล็กตรอน
ตอบ ข้อ 3
วิเคราะห์ข้อสอบ
เลขอะตอม (atomic number) หมายถึงจำนวนโปรตอนในนิวเคลียสของธาตุนั้นๆ หรือหมายถึงจำนวนอิเล็กตรอนที่วิ่งวนรอบนิวเคลียสของอะตอมที่เป็นกลาง เช่น ไฮโดรเจน (H) มีเลขอะตอมเท่ากับ 1
เลขอะตอม เดิมใช้หมายถึงลำดับของธาตุในตารางธาตุ เมื่อ ดมิทรี อีวาโนวิช เมนเดลีเยฟ (Dmitry Ivanovich Mendeleev) ทำการจัดกลุ่มของธาตุตามคุณสมบัติร่วมทางเคมีนั้น เขาได้สังเกตเห็นว่าเมื่อเรียงตามเลขมวลนั้น จะเกิดความไม่ลงรอยกันของคุณสมบัติ เช่น ไอโอดีน (Iodine) และเทลลูเรียม (Tellurium) นั้น เมื่อเรียกตามเลขมวล จะดูเหมือนอยู่ผิดตำแหน่งกัน ซึ่งเมื่อสลับที่กันจะดูเหมาะสมกว่า ดังนั้นเมื่อเรียงธาตุในตารางธาตุตามเลขอะตอม ตารางจะเรียงตามคุณสมบัติทางเคมีของธาตุ เลขอะตอมนี้ถึงแม้โดยประมาณ แล้วจะแปรผันตรงกับมวลของอะตอม แต่ในรายละเอียดแล้วเลขอะตอมนี้จะสะท้อนถึงคุณสมบัติของธาตุ
เฮนรี โมสลีย์ (Henry Moseley) ได้ค้นพบความสัมพันธ์ระหว่างการกระเจิงของ สเปกตรัมของรังสีเอ็กซ์ (x-ray)ของธาตุ และตำแหน่งที่ถูกต้องบนตารางธาตุ ในปี ค.ศ. 1913 ซึ่งต่อมาได้ถูกอธิบายด้วยเลขอะตอม ซึ่งอธิบายถึงปริมาณประจุในนิวเคลียส หรือ จำนวนโปรตอนนั่นเอง ซึ่งจำนวนของโปรตอนนี้เป็นตัวกำหนดคุณสมบัติทางเคมีของธาตุ
เลขอะตอม เดิมใช้หมายถึงลำดับของธาตุในตารางธาตุ เมื่อ ดมิทรี อีวาโนวิช เมนเดลีเยฟ (Dmitry Ivanovich Mendeleev) ทำการจัดกลุ่มของธาตุตามคุณสมบัติร่วมทางเคมีนั้น เขาได้สังเกตเห็นว่าเมื่อเรียงตามเลขมวลนั้น จะเกิดความไม่ลงรอยกันของคุณสมบัติ เช่น ไอโอดีน (Iodine) และเทลลูเรียม (Tellurium) นั้น เมื่อเรียกตามเลขมวล จะดูเหมือนอยู่ผิดตำแหน่งกัน ซึ่งเมื่อสลับที่กันจะดูเหมาะสมกว่า ดังนั้นเมื่อเรียงธาตุในตารางธาตุตามเลขอะตอม ตารางจะเรียงตามคุณสมบัติทางเคมีของธาตุ เลขอะตอมนี้ถึงแม้โดยประมาณ แล้วจะแปรผันตรงกับมวลของอะตอม แต่ในรายละเอียดแล้วเลขอะตอมนี้จะสะท้อนถึงคุณสมบัติของธาตุ
เฮนรี โมสลีย์ (Henry Moseley) ได้ค้นพบความสัมพันธ์ระหว่างการกระเจิงของ สเปกตรัมของรังสีเอ็กซ์ (x-ray)ของธาตุ และตำแหน่งที่ถูกต้องบนตารางธาตุ ในปี ค.ศ. 1913 ซึ่งต่อมาได้ถูกอธิบายด้วยเลขอะตอม ซึ่งอธิบายถึงปริมาณประจุในนิวเคลียส หรือ จำนวนโปรตอนนั่นเอง ซึ่งจำนวนของโปรตอนนี้เป็นตัวกำหนดคุณสมบัติทางเคมีของธาตุ
ตอบ ข้อ 3
ที่มา . trueplookpanya.com
วิเคราะห์ข้อสอบ
ออกซิเจน(อังกฤษ: Oxygen) เป็นธาตุในตารางธาตุที่มีสัญลักษณ์ O และเลขอะตอม 8 ธาตุนี้พบมาก ทั้งบนโลกและทั่วทั้งจักรวาล โมเลกุลออกซิเจน (O2 หรือที่มักเรียกว่า free oxygen) บนโลกมีความไม่เสถียรทางเทอร์โมไดนามิกส์จึงเกิดปฏิกิริยาออกซิเดชันกับธาตุอื่นๆ ได้ง่าย ออกซิเจนเกิดขึ้นครั้งแรกในโลกจากการสังเคราะห์ด้วยแสงของแบคทีเรียและพืช
ตอบ ข้อ 2
วิเคราะห์ข้อสอบ
ธาตุกัมมันตรังสี หมายถึง ธาตุที่แผ่รังสีได้ เนื่องจากนิวเคลียสของอะตอมไม่เสถียร เป็นธาตุที่มีเลขอะตอมสูงกว่า 82
กัมมันตภาพรังสี หมายถึง ปรากฏการณ์ที่ธาตุแผ่รังสีได้เองอย่างต่อเนื่อง รังสีที่ได้จากการสลายตัว มี 3 ชนิด คือ รังสีแอลฟา รังสีบีตา และรังสีแกมมา
ใน นิวเคลียสของธาตุประกอบด้วยโปรตอนซึ่งมีประจุบวกและนิวตรอนซึ่งเป็นกลางทาง ไฟฟ้า สัดส่วนของจำนวนโปรตอนต่อจำนวนนิวตรอนไม่เหมาะสมจนทำให้ธาตุนั้นไม่เสถียร ธาตุนั้นจึงปล่อยรังสีออกมาเพื่อปรับตัวเองให้เสถียร ซึ่งเป็นกระบวนการที่เกิดขึ้นเองตามธรรมชาติ เช่น
(ธาตุยูเรเนียม) (ธาตุทอเลียม) (อนุภาคแอลฟา)
ตารางที่ 7 ชนิดและสมบัติของรังสีบางชนิด
ชนิดของรังสี | สัญลักษณ์ | สมบัติ |
รังสีแอลฟา หรืออนุภาคแอลฟา | เป็น นิวเคลียสของอะตอมฮีเลียม มีโปรตอนและนิวตรอนอย่างละ 2 อนุภาค มีประจุไฟฟ้า +2 มีเลขมวล 4 มีอำนาจทะลุทะลวงต่ำเพียงแค่กระดาษ อากาศที่หนาประมาณ 2-3 cm น้ำที่หนาขนาดมิลลิเมตร หรือโลหะบางๆ ก็สามารถกั้นอนุภาคแอลฟาได้ | |
รังสีบีตา หรืออนุภาคบีตา | มี สมบัติเหมือนอิเล็กตรอน มีประจุไฟฟ้า -1 มีมวลเท่ากับอิเล็กตรอน (น้อยมาก) มีอำนาจทะลุทะลวงสูงกว่ารังสีแอลฟาประมาณ 100 เท่า สามารถผ่านแผ่นโลหะบางๆ ได้ และมีความเร็วใกล้เคียงกับความเร็วแสง | |
รังสีแกมมา | เป็น คลื่อนแม่เหล็กไฟฟ้าที่มีความยาวคลื่นสั้นมาก ไม่มีประจุ ไม่มีมวล เป็นรังสีที่มีพลังงานสูง มีความเร็วเท่ากับความเร็วแสงและมีอำนาจทะลุทะลวงสูง สามารถผ่านแผ่นตะกั่วหนา 8 mm หรือแผ่นคอนกรีตหนาๆ ได้ |
ภาพที่ 11 อำนาจทะลุทะลวงของรีงสีต่างๆ
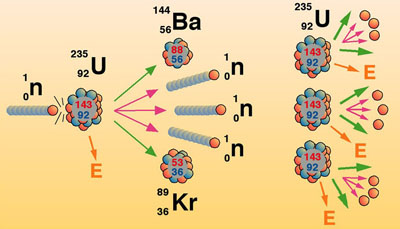
การเกิดปฏิกิริยาของธาตุกัมมันตรังสี การเกิดปฏิกิริยาของธาตุกัมมันตรังสี เรียกว่า ปฏิกิริยานิวเคลียร์ ซึ่งมี 2 ประเภท คือ
1. ปฏิกิริยาฟิชชัน (Fission reaction) คือ ปฏิกิริยานิวเคลียร์ที่เกิดขึ้น เนื่องจากการยิงอนุภาคนิวตรอนเข้าไปยังนิวเคลียสของธาตุหนัก แล้วทำให้นิวเคลียร์แตกออกเป็นนิวเคลียร์ที่เล็กลงสองส่วนกับให้อนุภาคนิวตรอน 2-3 อนุภาค และคายพลังงานมหาศาลออกมา ถ้าไม่สามารถควบคุมปฏิกิริยาได้อาจเกิดการระเบิดอย่างรุนแรงที่เรียกว่า ลูกระเบิดปรมาณู (Atomic bomb) เพื่อควบคุมปฏิกิริยาลูกโซ่ไม่ให้เกิดรุนแรงนักวิทยาศาสตร์จึงได้สร้างเตาปฏิกรณ์ปรมาณูเพื่อใช้ในการผลิตกระแสไฟฟ้า
1. ปฏิกิริยาฟิชชัน (Fission reaction) คือ ปฏิกิริยานิวเคลียร์ที่เกิดขึ้น เนื่องจากการยิงอนุภาคนิวตรอนเข้าไปยังนิวเคลียสของธาตุหนัก แล้วทำให้นิวเคลียร์แตกออกเป็นนิวเคลียร์ที่เล็กลงสองส่วนกับให้อนุภาคนิวตรอน 2-3 อนุภาค และคายพลังงานมหาศาลออกมา ถ้าไม่สามารถควบคุมปฏิกิริยาได้อาจเกิดการระเบิดอย่างรุนแรงที่เรียกว่า ลูกระเบิดปรมาณู (Atomic bomb) เพื่อควบคุมปฏิกิริยาลูกโซ่ไม่ให้เกิดรุนแรงนักวิทยาศาสตร์จึงได้สร้างเตาปฏิกรณ์ปรมาณูเพื่อใช้ในการผลิตกระแสไฟฟ้า










ไม่มีความคิดเห็น:
แสดงความคิดเห็น